KANSER ve BAĞIŞIKLIK SİSTEMİ
Basit bir hücrenin kanser hücresine dönüşümü çok basamaklı bir olaydır (1). Bu olay; yıllar içerisinde değişen hücrede meydana gelen genetik değişiklikleri içerir. Kontrolsüz çoğalma ve birikim sonucunda da tümör meydana gelir (1). Bağışıklık sistemi tarafından tanınan tümör hücreleri büyük olasılıkla yok edilirken; bağışıklık sisteminden gizlenmeyi başarabilen hücreler kaçarlar ve yaşarlar. Bağışıklık sisteminden kaçmayı ve mikroçevreye uyum sağlamayı başaran tümör hücreleri, bağışıklık sistemi hücrelerine karşı dirençli hale geçerler.
Burnett adlı araştırmacı yıllar önce, immün gözetim fikrini oluşturdu ve tümör hücrelerinin bağışıklık sistemi tarafından tanındığını ileri sürdü (2). Günümüz modern immün gözetim teorisi ise; kişinin bağışıklık sisteminin tümör hücrelerini saptama ve yok etme yeteneğine sahip olduğunun üzerinde durur. Ayrıca, tümör hücrelerinin bağışıklık sistemi için pasif hedefler olmadığını; kaçma ve kişinin bağışıklık sistemini etkisiz bırakabilme yeteneğinin de olduğunu savunur. Bu teori, tümör hücresi ile bağışıklık sistemi hücreleri ya da bunların ürünlerinin birbirleri ile etkileşimlerindeki karmaşıklığı kabullenmektedir. Bu etkileşimler sonucunda da sıklıkla tümör hücresinin değil, bağışıklık sistemi hücresinin öldüğü tahmin edilmektedir.
Bu yazıda; tümöre karşı gelişen bağışıklık yanıtın doğası ve yapısı ile tümör büyümesi ve metastazı (tümörün diğer dokulara sıçraması) sırasında bağışıklık sisteminin yetersiz kalmasının nedenlerini inceleyip tartıştım.
Tümör Gelişimi ve Kişinin Bağışıklık Sistemi
Tümör gelişimi esnasında, bağışıklık sisteminin değişimlerine dair gözlemler vardır. Kanser öncüsü odaklar gibi erken lezyonlar (örn: melanositik nevüs) genellikle bağışıklık sistemimimizin etkili hücreleri olan lenfosit, makrofaj, granülosit gibi hücreler tarafından kuşatmaya alınır (3,4). Kolon (kalın barsak), meme, ağız içi kanserleri gibi tümörlerin ileri evrelerinde tümörü kuşatan (infiltre eden) lenfositler (TİL)’ in tümör bölgesindeki varlığının hastanın yaşam süresini uzattığı gösterilmiştir (5).
Kanserli hastalardan alınan kanlardan elde edilen dolaşan öldürücü (periferik kan sitotoksik) T lenfosit (STL) ya da TİL hücrelerin laboratuar şartlarında olgunlaştırılması ve çoğaltılması ile bu hücrelerin anti-tümör fonksiyonlarının test edilmesi mümkün olmuştur (5). Birçok laboratuvar deneyinde, STL öncüllerinin dolaşımda ya da tümörün bulunduğu alanlarda var olduğu görülmektedir. Bunun yanında bir çok çalışmada tümöre ait protein parçacıklarına özgül cevap veren T hücrelerinin dolaşımda bulunduğu gösterilmiştir (6,7). Bu çalışmalar; kişilerin bağışıklık sistemlerinin tümörü tanıdığını, bölgesel ve genel bir immün yanıt ile tümöre cevap verdiğini göstermiştir (8).
Bu bilgiler ışığında, “eğer bağışıklık sistemi hücreleri tümörleri tanıyorsa; kanser neden ilerliyor?” şeklinde bir soru aklımıza geliyor. Bağışıklık sistemi; bakteri ve virüs yapılarına karşı antikor meydana getirir; çünkü, infeksiyonu tehlike sinyali olarak algılar (9). Oysa, tümörle ilişkili yapılar (antijenler) (TİA) ise vücut tarafından kendi antijeni gibi kabul edilir ve bu antijenlere karşı gelişen bağışıklık yanıtı yetersiz kalır. Aslında bu makaleye genel olarak bakıldığında; kanseri, otoimmün bir fenomen gibi değerlendirilmekte ve TİA’ e karşı etkili bir bağışıklık yanıtının oluşumuna engel olan immünolojik bir toleransın varlığını düşünmekteyim. Tümöre karşı etkili bir bağışıklık yanıtı gelişimine bir başka engel ise, tümörün etrafına saldığı ve bağışıklık sistemini baskılayıcı bazı faktörlerdir.
Kötü huylu tümör hücrelerine karşı gelişen bağışıklık yanıtı, lokal (bölgesel) ve sistemik (genel) olarak kategorize edilebilir.
Tümör Etrafındaki Bağışıklık Sistemi Hücreleri
T hücreleri; tümör bölgesinde en fazla görülen bağışıklık sistemi hücreleridir (10). Ancak bu hücrelerin tümörün ilerlemesine göre fonksiyonları değişiklik göstermektedir. Örneğin; metastatik ve erken evre tümörlülerden elde edilen TİL’ ler karşılaştırıldığı zaman; metastatik hastalığı olanlarda TİL fonksiyonlarının daha bozuk olduğu saptanmıştır. Bu bize; ileri evre tümörün bağışıklık sistemi hücrelerini baskıladığını göstermektedir. Yani tümörlerde kişilerde bir bağışıklık sistemi yetmezliği yaratmaktadır. Çalışmalar; tümör çevresindeki CD4+ ve CD8+T hücrelerinde fonksiyon bozukluğu olduğunu göstermektedir (11-15). Fonksiyonel bu bozukluğun derecesi hastalığın gidişatı ve yaşam süresini tahmin etmede önemli olabilir.
Bağışiklık sisteminin doğal öldürücü (Naturel Killer=NK) hücreleri, tümör hücrelerinin parçalanmasında görev alırlar. Buna rağmen pek çok tümör, NK’ lerin bu parçalama fonksiyonuna karşı dirençlidir. Tümör dokusu etrafındaki NK’ ler, TİL’ lere göre sayıca çok az bulunurlar (16).
Antikor yapımından sorumlu olan B hücreleri; meme kanseri ve bazı deri kanserleri (melanoma) dışındaki tümörlerde seyrek bulunur (3). Buna rağmen, tümöre özgül antikorlar kanser hastalarında sıklıkla saptanmaktadırlar.
Dentritik hücre (DH) denilen hücreler, TİA’ leri içine alır ve bunları tanımları ve reaksiyon göstermeleri için doğal ya da hafıza T lenfositlere sunar (18). Ancak bunun yanında tümörle karşılaşan DH’ lerin olgunlaşmasının bozulduğunu ve ölüme gittikleri görülmüştür (19). Pek çok çalışma, tümör bölgesinde DH varlığının hastalığının gidişatının daha iyi olması ile ilgili olduğunu göstermiştir (18). Ancak; metastatik lezyonlarda, ilk tümör odağına göre daha az miktarlarda DH bulunduğu saptanmıştır (20). Yani hastalığın ilerlemesi sonucunda DH cevabı da maalesef azalmaktadır. Bu da bağışıklık sisteminde sonradan oluşan bir yetersizliğe işaret edebilmektedir.
Makrofajlar olarak adlandırılan bağışıklık sistemi hücreleri de çoğunlukla tümörlerde bulunur ve tümör ile ilişkili makrofaj (TİM) olarak adlandırılır. Normalde makrofajlar antijeni T lenfositlere sunan hücreler olarak infeksiyon kontrolünde önemli rol oynarlar. TİM’ ler ise maalesef lenfosit fonksiyonlarını baskılamak üzere programlanmışlardır. Yapılan çalışmalarda; tümörün saldırganlığında, TİM sayısının etkili olduğu gösterilmiştir. Saldırgan (İnvaziv) meme kanserli hastalarda TİM sayı artışı, yaşam süresinin azalmasına neden olmuştur (21).
Tümörlü Hastalarda Kan Dolaşımındaki Bağışıklık Hücreleri
Bağışıklık sitemi hücrelerinin anti-tümör fonksiyonlarını laboratuar ortamında çalışmak için en önemli kaynak kandır. Yapılan çalışmaların sonucunda tümör bölgesindeki TİL’ lerde görülen fonksiyon bozukluğu, kanda dolaşan T lenfositinlerinde de (PKTL) gözlenmiştir (22,23). PKTL ve TİL’ lerin birlikte değerlendirildiği çalışmalarda deri kanserleri (melanoma), böbrek tümörü (renal hücreli) ve ağız içinde kanseri olan hastaların ortalama % 40’ ında T hücre fonksiyonlarında bozulma ve bu hücrelerin ölüm oranlarında artma gözlenmiştir (14,15,22). TİL hücrelerindeki eksiklikler PKTL’ den fazladır (15). Bu bilgilerle, T hücre fonksiyon bozukluğunun bu hem lokal hem de sistemik olabildiği söylenebilir.
Kan dolaşımındaki T hücrelerin de maalesef fonksiyonlarının bozuk olduğu ve çabucak ölüme gittikleri gösterilmiştir (22-29). Bu hücrelerin maalesef çok çabuk ölüme gitmesi tümörün bağışıklık sistemi tarafından bertaraf edilememesi ile sonuçlanır ve durum hastanın yaşam süresinin kısalması ile sonuçlanır.
Bir diğer anti-tümör hücre grubu olan NK; dolaşımda %8-10 arasında saptanır ve tümör hücrelerinin yok edilmesinde rol alır (26). Perforin gibi bazı enzimlerle tümör hücresini parçalamanın yanı sıra NK hücreleri, tümör hücresine bazı parçacıkları ile dokunarak tümör hücresini ölüme sürükler (30,31). NK hücreleri tümörden korunmada ve metastaz yayılımını kontrol etmede potansiyel role sahiptir; ama, bir kez tümör oluştumu, NK hücrelerin anti-tümör fonksiyonları tersine dönebilir.
Diğer bir özgül olmayan anti-kanser etkili hücre NK/T hücresidir. Normalde dolaşımda ve dokularda lenfositlerin çok küçük bir alt grubunu oluşturur; ama, tümörlü hastalarda sayıca arttıkları bildirilmiştir (32). Labortauvar şartlarında IL-2 dediğimiz sitokinle aktive edilip tekrar hastalara verilen ve daha etkili anti-kanser hücre olan “lenfokin ile aktive olmuş öldürücü hücre (LAK)” lere dönerler (16). Hedef tümör hücrelerini yok ederler.
Düzenleyici Bağışıklık Hücreleri
Kanserli hastalarda da dolaşımda normal insanlarda var olan baskılayıcı lenfositler diğer bağışıklık sistemi hücrelerinin fonksiyonlarını baskılamaktadır (33). Biz bu hücrelere regülatuar (düzenleyici) T lenfositler diyoruz (34). Bu hücrelerin kanserli hastalardaki fonksiyonlarının nasıl etkilendiğine dair yeterli çalışma şu an için yoktur.
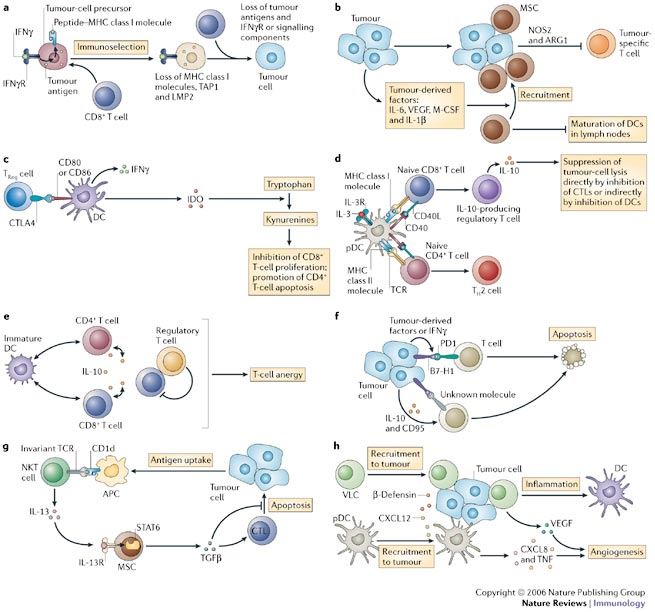
Tümörden Salınan ve Bağışıklık Sistemini Baskılayan Faktörler
Tümörler, bağışıklık 0sistemi hücreleri gibi sitokin ve diğer çözünebilen faktörleri üretirler. Ürettikleri bu faktörleri hem tümörün bulunduğu bölgeye hem de kan dolaşımına salarlar. Bu maddeler aracılığı ile anti-tümör etkili olan hücreleri etkisiz hale getirirler. Bunun dışında tümör hücrelerinden, anti-tümör etkili bağışıklık sistemi hücrelerini ölüme zorlayan birçok madde de salgılanır.
Anti-tümör Etkili Bağışıklık Cevabına Yeni Bakış Açıları
Tümöre cevap veren bağışıklık cevabı hakkında eskiden kalan yanlış düşünceler vardı;
1.) Kanser hücreleri bağışıklık sistemi hücreleri tarafından tanınmazlar;
2.) Bağışıklık sistemi yanıtları sadece tümör hücresi üzerinde yer alan antijenler ile yönlendirilir;
3.) Tek başına, tümöre özgül T hücreleri tümörün yok olmasını sağlamada yeterlidir;
4.) Anti-tümör yanıtlar için tümörler pasif hedeflerdir.
Bugün bu düşünceler yeni teoriler ile uyumlu değildir.
Yeni teori ve düşünce tarzına göre;
1.) Kanser hücreleri bağışıklık sistemi tarafından tanınırlar;
2.) TİA’ ler kişinin kendi proteinleri veya hücresel yapılarıdır ve bağışıklık yanıtı kişinin kendi yapılarına karşı meydana gelir (7).
3.) Tümöre karşı meydana gelen bağışıklık yanıtında TİA’ e özgül T hücreleri tek başına olmayıp, doğal immün yanıtta yer alan non-spesifik T hücresi, NK ve makrofajlar da rol alırlar.
4.) Anti-tümör immün yanıt için tümörler pasif hedef değildirler.
5.) Tümör tarafından yapılan karşı atak, kişinin bağışıklık sistemine karşıdır ve bağışıklık sisteminin fonksiyonlarını bozar (24-25).
SONUÇ
Tümöre karşı gelişen immün yanıt için daha önceki düşünceler; immün hücrelerin aktivasyonu ve anti-tümör fonksiyonlarının artması şeklinde iken, şu anki düşünceler ışığında tümör çevresindeki immün hücrelerin baskılanması ya da ölümüne neden olan bir immün gelişimden söz edilebilir.
Bu sonuca göre anti-tümör tedavi stratejileri;
1.) Hücre öldürücü (sitotoksik) T hücreleri ve diğer non-spesifik T hücreleri ölümden korumak ve ömrünü uzatmak;
2.) Tümör çevresindeki DH veya lenfositlerin fonksiyonlarını en iyi şekilde kullanmak;
3.) DH’ lerin; tümör yapılarını bağışıklık sistemi hücrelerine sunumunu güçlendirmek;
4.) Bağışıklık sisteminin baskılanmasını önlemek:
a. Tümörden salınan baskılayıcı faktörlerin üretiminin ve aktivitesinin ortadan kaldırılması,
b. Düzenleyici ya da bağışıklığı baskılayıcı (regülatuvar) hücre fonksiyonlarının azaltılması;
5. ) Erken dönemde tanı koyup tedaviye başlamak olarak sıralanabilir.
KAYNAKLAR
1- Zhang L, Zhou W, Velculescu VE, Kern SE, Hruban RH, Hamilton SR, et al. Gene expression profiles in normal and cancer cells. Science 1997; 276: 1268-1272.
2- Burnett FM, Wiad Lek. Nobel prize for F.M Burnett and P. B Medavar in 1960 for discovery of acquired immunological tolerance 1969 Mar 1; 22(5): 505-506
3- Kornstein MJ, Brooks JS, Elder DE. Immunperoxidase localization of lymphocyte subsets in the host responses to melanoma and nevi. Cancer Res 1983; 43: 2749-2753.
4- Von Kleist S, Berling J, Bohle W, Wittekind C. Immunohistochemical analysis of lymphocyte subpopulations infiltrating breast carcinomas and benign lesions. Int J cancer 1987; 40: 18-23.
5- Whiteside TL. Tumor infiltrating lymphocytes in human malignancies. Austin, Tex: RG Landes Co; 1993.
6-) Lee PP, Yee C, Savage PA, Fong L, Brockstedt D, Weber JS, et al. Characterization of circulating T cells specific for tumor-associated antigens in melanoma patients. Nat Med 1999;5: 677-685.
7-) Pittet MJ, Speiser DE, Lienard D, Valmore D, Guillaume P, Dutoit V, et al. Expansion and functional maturation of human tumor antigen-spesific CD(+ T cells after vaccination with antigenic peptide. Clin Cancer res 2001; 7: 796s-803s.
😎 Renkvist N, Castelli C, RobbinsPF, Parmiani G. A listing of human tumor antigens recognized by T cells. Cancer Immunol Immunother 2001; 50: 3-15.
9-) Matzinger P. An innate sense of danger. Sem Immunol 1998; 10: 399-415.
10-) Mihm M,Clemente C, Cascinelli N. Tumor infiltrating lymphocytes in lymph node melanoma metastases – a histopathologic prognostic indicator and an expression of local immune response. Lab Invest 1996; 74: 43-47.
11-) Kersh EN, Shaw AS, Allen PM. Fidelity of T cell activation through multistep T cell receptor z phosphorylation. Science 1998; 281: 572-575.
12-) May MJ; Ghosh S. Signal transduction through NF-kB. Immunol Today 1998; 19: 80-88.
13-) Reichert TE, Day E, Wagner EM, Whiteside TL. Absent of low expression of the z chain in T cells at the tumor site correlates with poor survival in patients with oral carcinoma. Cancer res 1998; 58: 5344-5347.
14-) Uzzo RG, Rayman P, Kolenko V, Clark PE, Cathcart MK, Bloom T, et al. Renal cell carcinoma- derived gangliosides suppress NFkB activation in T cells. J Clin Invest 1999; 104: 769-776.
15-) Reichert TE, Strauss L, Wagner EM, Gooding W, Whiteside TL. Signaling abnormalities, apopitosis and reduced proliferation of circulating and tumor- infiltrating lymphocytes in patients with oral carcinoma . Clin Cancer Res 2002. In Press.
16-) Whiteside TL, Vujanovic NL, Herberman RB.Natural killer cells and tumor therapy. Curr Topics Microbiol Immunol 1998; 230: 221-244.
17-) Kelly JM, Darcy PK, Markby JL, Godfrey DI, Takeda K, yagitab H, et al. Induction of tumor- spesific T cell memory by NK cell-mediated tumor rejection. Nat Immunol 2002; 3: 83-90.
18-) Reichert TE, Scheuer C, Day R, Wagner W, Whiteside TL. The number of intratumoral dendritic cells and z chain expression in T cells as prognostic and survival biomarkers in patients with oral carcinoma. Cancer 2001; 91: 2136-2147.
19-) Gabrilovich DI, Chen HL, Girgis KR, Cunningham HT, Meny GM, Nadaf S, et al. Production of vascular endothelial growth factor by human tumors inhibits the functional maturation of dendritic cells. Nat Med 1996;2: 1096-1103.
20-) Murphy GF, Radu A, Kaminer M, Berg D.Autologous melanoma vaccine induces inflammatory responses in melanoma metastases: relevance to immunologic regression and immunotherapy. J Invest Dermatol 1993; 100: 335S-341S.
21-) Leek RD, Lewis CE, Whitehouse R, et al. Association of macrophage infiltration with angiogenesis and prognosis in invasive breast carcinoma .Cancer Res 1996; 56: 4625-4629.
22-) Dworacki G, Meidenbauer N, Kuss I, Hoffmann TK, Gooding MS, Lotze M, et al. Decreased z chain expression and apopitosis in CD3+ peripheral blood T lymphocytes of patients with melanoma. Clin Cancer Res 2001; 7: 947s-957s.
23-) Finke JH, Rayman P, Tannenbaum GR, et al. Tumor- induced sensitivity to apopitosis in T cells from patients with renal cell carcinoma: role of nuclear factor kappa B suppression. Clin Cancer Res 2001; 7: 940s-946s.
24-) Whiteside TL. Tumor-induced death of immun cells: its mechanisms and consequences. Semin Cancer Biol 2001; 12: 43-50.
25-) O’ Connell J, O’ Sullivan GD, Collins JK, Shanahan F. The Fas counterattack: Fas- mediated T cell killing by colon cancer cells expressing Fas ligand. J Exp med 1996; 184: 1075-1082.
26-) Whiteside TL. Apopitosis of immune cells in the tumor microenvironment and peripheral circulation of patients with cancer: implications for immunotheraphy. Vaccine 2002. In Press.
27-) Kuss I, saito T, Johnson JT, et al. Clinical significance of decreased z chain expression in peripheral blood lymphocytes of patients with head and neck cancer. Clin Cancer Res 1999; 5: 329-334.
28-) Hoffmann TK, Dworacki G, Meidenbauer N, et al. Spontaneous apopitosis of circulating T lymphocytes in patients with head and neck cancer and its clinical importance. Clin Cancer Res 2002. In Press.
29-) Kuss I, Donnenberg AD, Ferris R, Gooding W, Whiteside TL. Effector CD(+ CD45RO- CD27- T cells have signaling defects in patients with head and neck cancer. Br J Cancer 2002. In Press.
30-) Vujanovic NL, Nagashima S, Herberman RB, Whiteside TL. Non- secretory apopitotic killing by natural killer cells. J Immunol 1996; 157: 1117-1126.
31-) Yokoyama WM. Natural killer cell receptors. Curr Opin Immunol 1998; 10: 298-305.
32-) Smyth MF, Godfrey DI. NKT cells and tumor immunity: a double- edged sword. Nat Immunol 2000; 1: 459-460.
33-) Gershon RK. A disquisition on suppressor T cells. Transpl Rev 1975; 26: 170-185.
34-) Ermann J, Szanya V, Ford GS, Paragas V, Fathman CG, Lejon K. CD4+ CD25+ T cells facilitate the induction of T cell anergy. J Immunol 2001; 167: 4271-4275.
Sağlıklı günler dileğiyle…
Prof. Dr. Cengiz KIRMAZ

