HIV ve AIDS
AIDS, HIV enfeksiyonu ile karakterize immün supresyon ile ortaya çıkan fırsatçı enfeksiyonlar, malign tümörler, aşırı zayıflama ve santral sinir sisteminde (SSS) dejenerasyon ile karakterize bir hastalıktır.
HIV, değişik immün hücreleri enfekte eder:
-CD4 + Th hücreler
-Makrofaj
-Dendritik hücreler
İlk defa 1980’ lerde tanımlanmış olup giderek büyüyen bir sorundur. HIV ile enfekte 50-60 milyon insan vardır. 20 milyon ölüm olmuştur (erişkin ve çocuk).
Her yıl 5 milyon yeni enfeksiyon, 3 milyon ölüm olmaktadır.
Halen bir koruyucu yada kür sağlanamamıştır.
HIV’ in Moleküler ve Biyolojik Özellikleri
HIV, hayvan retro virüslerinden lenti virüs ailesindendir. Lenti virüsler (visna virüsleri içeren) koyun ve ineklerde, kedi gillerde ve maymunlarda (simian immün eksiklik virüsü (SIV)) uzun süreli latent enfeksiyon yapar. Kısa süreli sitopatik etkisi olan ve yavaş ilerleyen, zayıflatan ve SSS dejenerasyonu yapan ajanlardır.
HIV’ a ait iki alt tip tanımlanmıştır:
-HIV-I
-HIV-II
HIV-I, AIDS’ in en çok nedeni olan virüstür. HIV-II ise değişik genomik yapı ve antijeniteye sahip olup benzer klinik sendroma sebep olabilir.
HIV Yapısı ve Genleri
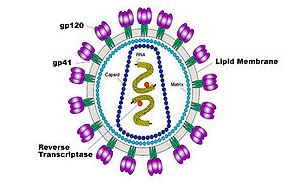
HIV iki idantik RNA sarmalı, viral cor protein ile paketlenmiş ve etrafında fosfolipid zarı içeren (Konakçı hücre membranından derive fakat virusla kodlanmış membran proteinleri içerir) bir yapıdır. Genetik olarak GAG sekansı core yapısı için gereklidir. ENV sekansı gp120 ve gp41 glikoproteinleri gelişmesi için; bu proteinler de hücreyi enfekte edebilmesi için gereklidir.
POL sekansı Reverse transkriptaz, viral replikasyon için gerekli; integrase ise viral proteaz için gereklidir.
Ayrıca HIV-I, TAT, REV, VIF, NEF, VPR ve VPV olarak altı tane regülatör gen içerir. Bunlarda değişik yollarla viral reprodüksiyonda görevlidir.
VİRAL YAŞAM DÖNGÜSÜ
HIV enfeksiyonu ENV ürünü olan glikoproteinlerin (gp120, gp41) CD4 ve kemokin reseptör ailesine üye bir coreseptöre bağlanması ile başlar. Viral partiküller; kan, semen ve diğer vücut sıvılarında bulunur. Seksüel kontakt, iğne batması ve transplasental olarak geçebilir. ENV gen sekansı ürünleri gp41(transmembran), gp120 (eksternal) subünit glikoproteinler yapar. Bu glikoproteinler gp160 prekürsöründen proteolitik parçalanma ile elde edilir. Hedef hücreye bağlanma esnasının ilk basamağında gp120 subünitin CD4 molekülüne bağlanması gereklidir. Bunun sonucu olarak gp120’ de kemokin koreseptöre bağlanmak için konformasyonel bir değişim başlatılır. Koreseptör bağlanması ise gp41’ de konformasyonel değişikliği başlatır. Sonuç olarak hidrofobik bölüm eksprese olur. Buna füzyon peptidi denir. Bunu sonucu olarak viral memebran hedef hücre ile birleşir. Hücre içine giren HIV virüsü, enfekte ettiği hücrenin plasma membranında gp120 ve gp41’ in eksprese olmasını sağlar. Bu da sağlam hedef hücreyi CD4 ve koreseptör bölümünden bağlar, HIV genomu direk olarak füzyona uğratılmış sağlam hücreye geçer.
Normalde HIV’ in koresptör olarak kullandığı CCR5 resptörlerine, RANTES (regulated by activation, normal T cell expressed and secreted), MIP-1α (makrofaj ınflamatory protein)
MIP1 bağlanır.
Rekombinant CCR5 reseptörünün transfekte edildiği hücre hatlarının makrofaj tropik virüs enfeksiyonuna dirençli olduğu gözlenmişitir. 7’ den fazla değişik kemokin koreseptörü HIV’ in hücre içine girmesi için koreseptör olarak gösterilmiştir.
Hastalığın erken safhalarında CCR5 reseptörü, makrofaj-tropik
geç safhalarında CXCR4 reseptörü T-cell tropik virüs için koreseptör olarak görev yaparlar.
CCR5’ i eksprese etmeyen kişilerin HIV enfeksiyonuna rezistansı olduğu gösterilmiştir.
Virüs hücre içine girdiğinde nükleoprotein kompleksindeki enzimler aktive olur ve viral reprodüktif siklus başlar. Virüs hücre içine girince viral RNA genomu viral reverse transkriptaz ile çift sarmallı DNA formuna geçer ve viral DNA, enfekte ettiği hücrenin nükleusuna geçer. Viral integraz ile viral DNA konakçı genomuna integre olur. İntegre HIV DNA’ ya provirüs denir. Bu provirüs aylarca hatta yıllarca inaktif kalabilir ve hiçbir viral protein ya da virion üretmez (latent durumu)
İntegre DNA provirüs gen transkripsiyonu LTR ile düzenlenir, sitokinler ve T hücre ve makrofajlar için diğer fizyolojik stimuluslar viral gen transkripsiyonu arttırabilir.
Thücreler için poliklonal aktivatörler:
PAH, IL-2, TNF, lenfotoksin HIV gen ekspresyonunu enfekte T hücrede arttırır.
Monosit ve makrofajlarda:
IL-1, IL-3, IL-6, TNF, Lenfotoksin, IFN-, GM-CSF HIV gen ekspresyonunu ve viral replikasyonu arttırır.
Bu yolaklar NFβ yolağına bağlı olan LTR ile sağlanır.
HIV HASTALIĞININ GİDİŞİ
AIDS gelişimi, HIV’ in konakçı immün sistemini yıkması ve konakçı immün yanıtının HIV’ eradike edememesine bağlıdır.
HIV ENFEKSİYONU VE PATOGENEZİNİN BASAMAKLARI
HIV hastalığı adaptiv immün yanıtla kontrol edilen ve periferal lenfoid dokuların progresif kronik enfeksiyonuna ilerleyen akut enfeksiyon ile başlar. HIV enfeksiyonunun gidişi hasta plasmasındaki virüs miktarı ve kandaki CD4+ T hücre sayısı ile takip edilebilir.Virüsün alındığı yerdeki lokal immün hücreler ve kandaki T lenfositler ilk enfekte olan hücrelerdir. En önemli erken enfeksiyon hücresi dendritik hücrelerdir. Mannoz binding lectin (MBL) ile virüsü bağlar, hücre içine alır ve lokal lenfatik dokulara götürür. Burada dendritik hücre ile CD4+ T hücrelerin direk kontağı esnasında HIV, CD4+ T hücrelere geçer. Birkaç gün sonra lenf nodlarında çok miktarda HIV replike olur. Buna VİREMİ safhası denir. Bu viremi sırasında virüs tüm vücut T hücreleri, makrofaj ve dendritik hücrelere ve periferik lenfoid dokuya bulaşır. HIV adaptiv immün sistem ile bundan sonra karşılaşmış olur. Bu sırada enfeksiyon parsiyel olarak kontrol edilmiş olur. Viremi ilk bulaştan yaklaşık 12 hafta sonra oluşur. Başlangıçta ki akut enfeksiyondan sonra hastalığı ikinci fazı gelişir. Burada lenf nodları ve dalakta HIV sürekli replike olur ve hücre dekstrüksiyonu gelişir. Bu periot latent periot olarak tanımlanır. Bu esnada immün sistem birçok mikroba ve oprtunistik ajan yanıt verebilir haldedir. Lenf nodlarında % 90 CD 4+ T hücre normaldir, ama hergün bir–iki milyar T lenfosit yıkılır. Bu esnada lenf nodundaki CD4+ T lenfositlerin % 10 u enfekte, periferde ise % 0,1 i enfektedir.
Kronik progresif fazda hasta diğer enfeksiyonlara yatkın hale gelir. Bu enfeksiyonlar da HIV prodüksiyonunu stimüle eder ve lenfoid dokunun dekstrüksiyonun hızlandırır.
HIV hastalığı son olarak letal faza geçer. Buna AIDS diyoruz. Burada artık CD 4+ T hücre sayısı 200 hücre/mm3 altına inmiştir. Bundan sonra artık kişiler diğer fırsatçı enfeksiyonlar, neoplaziler, kaşeksi (HIV wasting sendromu), böbrek yetmezliği (HIV nefropati) ve SSS dejenerasyonuna (AIDS ensefalopati) açıktırlar. AIDS ile ilişkili bu klinik tablo CD4+ T hücre sayısı 200/mm3 altına düşmedikçe oluşmaz
HIV REZERVUARLARI VE VİRAL TURNOVER
Matematiksel olarak 3 rezervuar faz vardır.
1. faz kısa yaşam ömürlü hücreler (CD 4+ T hücreler)
2. faz makrofajlar (yavaş virus salan rezervuarlar)
3. faz çok yavaş plazmaya HIV salınması, latent enfekte memory T hücreler
İMMUN YETMEZLİĞİN MEKANİZMALARI
HIV hem adaptif hem de innate immün sistemde yetmezlik yapar. En önemli etki hücre aracılı immünite üzerindeki etkisidir. Bunu direkt sitopatik etki veya indirekt etkilerle yapar.
CD 4+ T hücrelerin en önemli kayıp nedeni HIV in bu hücrelere direk sitopatik etki göstermesidir.
SİTOPATİK ETKİ:
-gp 41 plazma membran ekspresyonu nedeni ile plazma membran permeabilitesi artar. Hücre içine letal miktarda fazla kalsiyum girer, apopitozis indüklenir veya osmotik lizis ile hücre ölür.
-Viral ürünler hücre yaşamı için gerekli proteinlerle interferans gösterebilir.
-İntegre olmamış viral DNA yada çok miktarda üretilmiş nonfonksiyonel viral RNA enfekte hücre için toksik olabilir.
-HIV ile enfekte CD4+ T hücreler gp120 eksprese ederler ve enfekte olmayan CD4+T hücreye bağlanırlar. Buna sinsitya (multinukleuslu dev hücre) denir ve bu letaldir. Ancak bu daha çok in vitro görülür.AIDS’ lilerde aman aman sinsitya oluşumu görülmez. Direk lizisese ek olarak; HIV ile enfekte kişilerde CD4+ T hücrelerin fonksiyonu azalır yada kaybolur.
-Enfekte olmayan T hücreler belki devamlı bir aktivasyona gidiyorlar. Bu da AICD (Activation Induced Cell Death=Aktivasyonla indüklenen hücre ölümü) ile apopitozis yapıyor olabilir. Ancak burada olay ölüm reseptörleri (apoptotik reseptörler) aracılığı ile olmaz.
-HIV spesifik CTL hücreleri bazı AIDS’ li vakalarda gösterilmiş; bu HIV ile enfekte CT4+ T hücreleri öldürüyor olabilir.
-HIV’ e karşı gelişen antikorlarla HIV taşıyan CD4+T hücre bağlanabilir ve ADCC (Antibody Dependent Cell Cytotoxicity=Antikor Bağımlı Hücre Ölümü) ile öldürebilir.
-Hücre içinde gp120 yeni sentezlenen hücre içi CD4’ e bağlanıp ekspresyonunu bloke edebilir. Bu da bu hücrenin antijenik stimülasyona yanıtsızlığı ile sonuçlanabilir.
– HIV ile enfekte vakalarda Th1 azalır, Th2 artar Hücre içi mikrop enfeksiyonu artar
-Makrofajlar, dendritik hücreler ve foliküler dendritik hücreler HIV enfeksiyonu progresyonunda ve immün eksiklik gelişiminde önemli rol oynayabilir.
-Makrofajlar T helper hücrelerden daha az miktarda CD4 eksprese etse de yoğun CCR5 koreseptör eksprese ederler ve HIV enfeksiyonuna duyarlılık artar. Ancak rölatif olarak makrofajlar HIV’ in sitopatik etkilerine rezistandırlar. Çünkü rölatif olarak bu etki hücrenin ne denli CD4 eksprese ettiğine bağlıdır.
-Makrofajlar gp120/ gp41 yolağından ayrıca Fc reseptör aracılı endositoz ile antikor kaplı HIV virionunu içine alıp enfekte olabilirler. Bu durumda makrofaj enfekte ölür. Ama genellikle virüs tarafından öldürülmez bir virüs için rezervuar olur.
-Dendritik hücrelerde HIV ile enfekte olabilir. Makrofajlar gibi dendritik hücrelerde HIV enfeksiyonunca direk hasara uğramazlar. Bunlar ilişkileri sırasında naive T hücreleri enfekte ederler.
-Foliküler dendritik hücreler ( FDCs) lenf nodlarının germinal merkezlerinde ve dalakta bulunurlar ve Fc aracılı antikor kaplı virüs ile enfekte olurlar. Buna rağmen etkili olarak enfekte olmazlar. Lenf nodlarında makrofaj ve CD4+ Thücreleri enfekte ederler.
HIV’ e KARŞI İMMÜN CEVAP
HIV ile enfekte vakalarda hem humoral hem de hücre aracılı HIV gen ürünlerine spesifik yanıtlar gelişir. HIV’ e erken yanıt tüm diğer virüslere olduğu gibi virüsün kandan dolaşan T hücreşlerden temizlenmesini kapsar. Ancak maalesef bu virüsün eradikasyonuna yetmez.
Başlangıç adaptive immün yanıt HIV proteinlerinden derive peptidlere spesifik CTL (CD8)’ in masif artışı ile karakterizedir.
HIV antijenlerine antikor yanıtı enfeksiyondan 6-9 hafta sonra saptanabilir hale gelir. Ancak antikorun enfeksiyon kontrolündeki yararlı etkilerine dair çok az kanıt vardır. En önemli antikor yanıtını oluşturan moleküller gp120 ve gp41’ dir. Diğer antikorlar antip24, reversetranskriptaz antikor, gag ve pol ürünlerine antikorlardır.
ADCC’ den sorumlu antikor genellikle gp120’ ye karşı antikordur.
HIV’ in İMMÜN EVAZYON (İMMÜN KAÇMA) MEKANİZMALARI
HIV reversetranskriptaz enzimi açısında çok yüksek düzeyde mutasyon kapatisine sahiptir.
HIV ile enfekte hücreler MHC Class1 ekspresyonunun down regüle edilmesi nedeniyle CTL’ lerden kaçabilir.
-HIV Nef protein HLA-A ve HLA-B gibi MHC class1 ekspresyonunu baskılayabilir.
-HIV enfeksiyonu hücre aracılı immüniteyi inhibe eder. HIV, Th2’ yi rölatif olarak Th1’ e göre arttırır. Th2 sitokinler hücre aracılı immüniteyi baskılarlar.
HIV GEÇİŞİ ve AIDS EPİDEMİYOLOJİSİ
3 major yol ile geçiş olur.
-Kontrolsüz seksüel kontakt. En sık geçiş yoludur. (Heteroseksüel çift yada homoseksüel erkeklerde)
-Kan ve kan ürünleri ile inokülasyon: İkinci sıklıkla geçiş yolu. İV ilaç kullanım alışkanlığı olanlarda iğnenelierin paylaşılması buradaki ensık formdur.
-Anneden çocuğa geçiş. İnutero, doğum yada muhtemel emzirme ile geçebilir.
AIDS TEDAVİSİ KORUNMA ve AŞI GELİŞTİRME ÇALIŞMALARI
Şu anda 3 sınıf antiviral ilaç var ve kombine kullanınıyorlar.
I. TİP: Nükleozid analogları reversetranskriptazı inhibe ederler (AZT :3’ azido-3’deoksitimidin), deoksisidin nükleozid analogları, deoksiadenozin analogları.
Bunların yalnız kullanılması plazma HIV RNA düzeylerini aylarca yıllarca düşürebilir. Ancak HIV’ ın oluşturduğu hastalığın progresyonunu enfelleyemez çünkü virüs reversetranskriptaz için yüksek düzeyde mutasyon formu oluşturur ve bu ilaçlara rezistans gelişir.
II. TİP: Daha yakın zamanlarda viral kapsid ve core protein oluşumunu sağlayan prekürsör proteinlerin oluşumunu bloke eden proteaz inhibitörleri geliştirilmiştir. Yalnız kullanıldıklarında hemen rezistans mutanat suşlar oluşur. Ama bunlar genel olarak şu anda iki değişik reversetranskriptaz inhibitörü ile birlikte kullanılmaktadır. Bunu üçlü ilaç tedavavisi HAART( Higly active antiretroviral therapy). Üç yıl gibi viral RNA’ nın undetectable olmasını sağlıyor.
III. TİP: Viral girişin engellenmesini sağlayan ( kemokin reseptör antagonistleri ve viral hücre membran füzyon inhibitörleri) ilaçlar ve integraz inhibitörleri. Bunlar deney aşamasındadır.
En iyi yöntem uygun metodlarla hastalığın endemik olduğu bölgelerde HIV’ den korunmaktadır( kondom, kan ürünlerinin iyi taranması, iğne paylaşımının engellenmesi)
-Dünyada en önemli biomedikal araştırmaların konusu HIV’ ekarşı etkili aşı geliştirme çalışmalarıdır.
-Makaklarda AIDS benzeri hastalık yapan SIV virüs aşısı geliştirilmiştir. Bir çok değişik canlı virüs aşısı denemiş ve güçlü CTL yanıtı alınmıştır. Bunun dışında rekombinan aşılar ve NEF geni aşıları denenmiştir.
-Canarypox vektörü ile HIV-1 genleri aşı olarak verilmiş ve güçlü CTL yanıtı yapmış. Araştırmalar en iyi sonuçların canlı virüslerle yapılan aşılardan alınabileceğini göstermektedir.
Sağlıklı günler dileğiyle,
Prof. Dr. Cengiz KIRMAZ

