RADYOKONTRAST MADDELERE KARŞI ALERJİ
Özet:
Radyokontrast maddeler tanı ve tedavi için dünyada milyonlarca kişiye kullanılmaktadır. Ciddi alerjik reaksiyon yaşanma olasılığı çok düşük olsa da yapılan uygulama sayısından dolayı oldukça fazla kişide görülebilir. Bu ajanlar ile ilacın kemotosik yan etkileri ve alerjik reaksiyonlar (non-IgE aracılı ve IgE aracılı ani başlangıçlı veya T hücre aracılı geç başlangıçlı) görülebilir. Hiçbir uygulama ile alerjik reaksiyon gelişme riski tamamen ortadan kaldırılamasa da en aza indirmek için deri testleri (prick, intradermal, yama) ve premedikasyon tedavisi kullanılabilir. Alerjik reaksiyonların kimde ve nasıl ortaya çıkacağı her zaman Biz bu incelemede radyokontrast maddeler ile yaşanabilecek reaksiyonlara yaklaşımı anlatmaya çalışacağım.
Giriş:
Radyokontrast maddeler (RM) çoğunlukla organik iyot türevlerini içeren ajanlardır. Çeşitli hastalıkların tanı ve tedavisinin gerçekleştirilebilmesi için anjiografi, venografi, ürografi, bilgisayarlı tomografi gibi işlemlerde kullanılır.1-4 RM ile ciddi alerjik reaksiyon sıklığı az olmakla birlikte her yıl milyonlarca (dünyada yılda 75 milyondan daha fazla) dozda uygulandığı düşünüldüğünde bu riski taşıyan hastaların sayısının yüksek olduğu görülür.5,6
İyotlu kontrast maddeler; molekül yüküne göre iyonik-noniyonik; molekül yapısına göre monomer-dimer; osmolalitesine [serum ozmolalitesine göre (275-290 mOsm/kg)] göre yüksek-düşük-isoosmolal olarak sınıflandırılabilir (Şekil 1).1,5,7-9 Her gruptaki ajanlar ile elde edilen görüntü kalitesi ve görülen yan etkiler faklıdır. İyonik monomerler diğer RM’lere göre ucuzdur ve yan etki profili nedeni ile genellikle sistogram gibi damar dışı işlemler dışında pek kullanılmazlar.7,10,11
RM’ler ile hem ilacın farmakolojisi ilgili yan etkiler hem de aşırı duyarlılık reaksiyonları yaşanabilir. RM’lere karşı gelişen immünolojik ilaç reaksiyonları ani başlangıçlı (uygulandıktan sonra 1 saat içinde) ve geç başlangıçlı (uygulandıktan sonra 1 saat-7 gün içinde) reaksiyonlar şeklinde sınıflandırılabilir.3,12
Biz bu incelmede RM’lere karşı gelişen özellikle alerjik reaksiyonları anlatmaya çalışacağız.
Şekil 1: Radkontrast madde tipleri:
Epidemiyoloji:
RM ile ani başlangıçlı reaksiyonlar (ABr) en sık 20-50 yaş arasındaki kişilerde görülür.13 Yaşlılarda genel populasyona göre çok daha yüksek oranda gelişen komplikasyonlar ve mortalite bildirilmiştir.14
Gelişen reaksiyonlar RM’nin ozmolaritesi, yükü, iyonize olup olmaması, uygulama hızı ve hastaların özelliklerinden etkilenebilir.15,16 Düşük osmolaliteli noniyonik kontrast maddeler, yüksek ozmolaliteli iyonik olanların yerine kullanılmaya başlandıktan sonra ani başlangıçlı aşırı duyarlılık reaksiyon insidansı %3,8-12,7 ‘den %0,7-3,1’e kadar gerilemiştir. Benzer şekilde, ciddi ani başlangıçlı aşırı duyarlılık insidansı %0,1-0,4’den %0.01-0.04’e düşmüştür.2,17 Ancak mortalite sıklığı RM grubu ne olursa olsun 1-3/100,000-1,000,000 oranında görülür.2,6,14
ABr’lerin yaklaşık %70’i enjeksiyondan sonra ilk 5 dakika içinde meydana gelir. Uygulamadan sonra ilk 20 dakika içinde yaşanan reaksiyonlarda anafilaktik şok, şiddetli anjiyoödem, akciğer ödemi ve kardiyak arrest gibi ciddi veya ölümcül durumların görülme olasılığı %96’dır.18
Geç başlangıçlı reaksiyonkların (GBr) tahmini olarak prevalansı yaklaşık %2 -%8’dir (19). İnterlökin-2 (IL-2) tedavisi alan veya noniyonik dimer RM kullanılan hastalarda daha sık görülebilir.1,19-27
Patofizyoloji:
RM ile gelişen reaksiyonların çoğunun patofizyolojisi tam olarak anlaşılamamıştır. Bu nedenle reaksiyonların şiddeti, zamanlaması, belirti ve bulguları ya da varsayılan patofizyolojisine dayalı çeşitli sınıflandırmalar yapılmıştır .6 RM ile gelişen reaksiyonlar; vazovagal reaksiyonlar dahil olmak üzere kemotoksik ve aşırı duyarlılık reaksiyonları olarak iki gruba ayrılabilir.
Kemotoksik reaksiyonlar RM’nin kimyasal özellikleri ile ilgilidir. Daha çok ajanın kullanılan dozuna, infüzyon hızına, ozmolalitesine bağlı olarak gelişir (aritmi, nefrotoksisite,hipertiroidizm gibi). Vazovagal reaksiyonlar ise bazen herhangi bir RM uygulanmadan hatta intra venöz (IV) katater takılmadan bile önce gelişebilir. Sinoatriyal depresyon, atriyoventriküler nodal aktivite ve atriyoventriküler iletim inhibisyonu artan vagal tonus ile ilişkilidir.1
RM ile gelişen aşırı duyarlılık reaksiyonları idiyosenkratiktir ve genellike doz veya infüzyon hızına bağlı değildir.
ABr’ larının çoğu non-IgE ve az bir kısmı da IgE ilişkili olarak geliştiği düşünülmektedir. Altta yatan mekanizma mast hücrelerinin aktive olması ile ilişkilidir.29 Mast hücrelerinin aktivasyonu hem IgE bağımlı hem de IgE bağımsız bir şekilde gerçekleşebilir.29-31 Direkt mast hücre aktiflenmesine neden olan reaksiyonlar ‘pseudo-alerjik reaksiyon/anafilaktik reaksiyon/nonallerjik anafilaksi’ olarak adlandırılır.12,16 Klasik yolda IgE aracılı mast hücresi aktivasyonu antijen-spesifik IgE ile FcεR1 reseptörlerinin çapraz bağlanması ile oluşur.16,32 Sonuçta mast hücre aktivasyonu ile degranülasyon uyarılarak öncelikle granüllerde depolanan ve mast hücre akut etkilerinden en çok sorumlu olan mediyatörler (histamin, triptaz, heparin ve serotonin gibi) salınır. Nispeten subakut etkilerden sorumlu olan lipid türevi mediyatörleri (prostaglandin D2, lökotrien C4, platelet activating faktör gibi) de sentez edilmeye başlanır .
Non-IgE aracılı mekanizmaların patofizyolojisi tartışmalıdır. Çünkü büyük ölçüde olgu raporları ve küçük hasta sayılı in vitro çalışmalara dayalıdır. Reaksiyon yaşayan hastalarda serum ve hücrede tespit edilen in vitro bulgular, reaksiyon yaşamamış normal kontrollerde de görülebilir.29,33 Reaksiyon oluşmasının; doğrudan mast hücre aktivasyonu, koagülasyon aktivasyonu, kinin ve/veya kompleman yolakları aktivasyonu , trombosit agregasyonu inhibisyonu (artan serotonin salınması ile) ve enzimlerin inhibisyonu (kolinesteraz gibi) gibi nedenlerle olduğu düşünülmektedir.7,16,34-36 İyoheksol, iyopamidol, iyoversol, iyoksaglat gibi RM’ler ile kompleman sistemi uyarılabilir.6,16,34 Kompleman sistem uyarılması ile anafilatoksinler (C3a, C4a ve C5a gibi ) üretilerek anafilaktik reaksiyon gelişebilir.
Geçmişte pek dikkate alınmamış olsa da RM’ye özgü IgE antikorların gösterildiği çalışmalar vardır.29,31,37,38 Örneğin Laroche ve arkadaşları RM ile ciddi ABr yaşamış hastalarda serum triptaz ve anti-RM-IgE düzeylerinin yüksek olduğunu göstermiştir.1,29 Bu bulgu da IgE aracılı tip I aşırı duyarlılık reaksiyonunu destekler.
Gelişen GBr’lerin T-hücre aracılı tip IV aşırı duyarlılık reaksiyonu olduğu ve RM molekülünün kendisine karşı üretilen bir reaksiyon olduğu (iyota değil) düşünülmektedir .1,39 Etkilenen deri bölgelerinden alınan biyopsilerde T hücrelerinin perivasküler infiltrasyonu ve bazen de eozinofillerin görülmesi,40 suçlu RM ile saptanan pozitif cilt testleri ve lenfosit proliferasyon testleri T-hücresi ilişkisini destekler
Klinik:
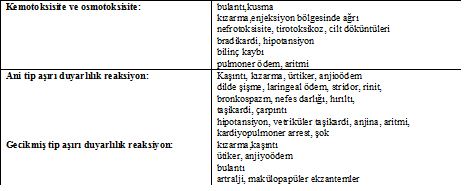
RM ile ani başlangıçlı aşırı duyarlılık reaksiyonları genellikle uygulamayı takiben 1 saat içinde ve çoğunlukla da 5 dakikaya kadar gelişir.16,43 Ciddi anafilaktik reaksiyonlar oluşabilse de37 semptomlar genellikle hafiftir ve deri en sık tutulan organdır.43 Gelişen reaksiyon IgE bağımlı olsa da olmasa da klinik görünüm anafilaksi gibidir ve gelişip gelişmeyeceği önceden tahmin edilemez. IgE bağımsız olaylarda RM ile ilk temasta yani önceden sensitizasyon olmadan reaksiyon gerçekleşir.1,44-46Klinikte kızarma, kaşıntı, ürtiker, anjioödem, bronkospazm, hırıltılı solunum, dispne, taşikardi, larenks ödemi, stridor, hipotansiyon, kardiyovasküler kollaps, şok ve bilinç kaybı görülebilir.21-23,25,47 Eğer koroner anjiyografi sırasında gelişirse koroner arter spazmı olabilir
Geçikmiş tip aşırı duyarlılık reaksiyonları RM uygulanmasından sonra 1 saat- 1 hafta, çoğunlukla da 3 gün içinde meydana gelir24,49,50 ve en sık tutulan organ burada da deridir.43 Klinikte en yaygın olarak kaşıntılı makülopapüler döküntü görülür.1,49-51Diğer semptomlar ürtiker, anjiyoödem ve cilt erüpsiyonudur.18,20,43,49,52Sıklıkla cilt reaksiyonları hafiftir ve genellikle kendi kendini sınırlayarak 7 gün içinde geriler.26,49,50 GBr’ler, ABr’lere göre daha hafif seyretme eğilimindedir.49Fakat nadiren fiks ilaç döküntüsü, vaskülit, akut jeneralize ekzantematöz püstülozis, toksik epidermal nekroliz veya Stevens-Johnson Sendromu görülebilir.1,5,18,21,23,25,53-55
Tanı:
RM ile gelişen ani aşırı duyarlılık reaksiyonları tanısı tamamen karakteristik belirti ve bulguların tanınmasına dayanır ve test yapılmadan da tanı konabilir. Bu nedenle öncelikle ayrıntılı bir anamnez alınmalıdır.
Bazı laboratuvar ve deri testleri tanıyı desteklemek için kullanılmaktadır. Ani aşırı duyarlılığı araştırmak için kullanılan testler çoğu ileri sağlık kuruluşlarının bile rutin laboratuvar test menüsünde bulunmaz. Hafif reaksiyonlarda genellikle yükseklik olmasa da şiddettli ani aşırı duyarlılık reaksiyonundan hemen sonra alınan serum ve idrarda mast hücreleri ve bazofillerin reaksiyona katılımını gösteren triptaz veya histamin yükselmesi tespit edilebilir.29,56,57Triptazın yarı ömrü 90 dakikadır ve akut bir olayda 30 dakika-3 saat içinde en iyi tespit edilir. Serum seviyelerindeki yükseklik ile ciddi ve fatal reaksiyonlar arasında ilişki vardır.29,56 Normal triptaz düzeyleri anafilaksiyi dışlatmaz fakat yükseklik var ise anafilaktik reaksiyon veya nadir bir durum olan mastositozis ile ilişkilidir. Histaminin metabolizması daha hızlı olduğundan plazma içinde sadece geçici olarak tespit edilir. İdrarda ise histamin veya metaboliti N-metilhistamin daha uzun süre saptanabilir ve reaksiyondan sonra en kısa sürede toplanan 24 saatlik idrar numunesinde ölçülür. Ancak bu testlerin tanısal ve prognostik yararları spesifik olarak RM ile gelişen ani aşırı duyarlılık reaksiyonu için çalışılmamıştır.
Deri testleri genellikle bir maddeye karşı IgE aracılı ya da T hücre aracılı reaksiyon gelişme olasılığını tespit etmek ve alerji tanısını desteklemek için irrite edici olmayan konsantrasyonda madde ile yapılır. Ancak test yapılan madde ile deri mast hücreleri direkt aktivasyonu da olabileceğinden, pozitif deri testi her zaman hastanın IgE aracılı alerjisi olduğunu ispatlamaz. Bu nedenle elde edilen sonuçlar klinikle birlikte değerlendirilmelidir.
Deri testi planlanırken radyolog ile görüşülerek önceki reaksiyona neden olan ajana alternatif olabilecek ajan belirlenir. Test önceki reaksiyondan sonra 2-6 ay içinde yapılmalıdır. Çünkü pozitiflik bu süre öncesi veya sonrasında daha düşük orandadır .30 Genel olarak intradermal deri testi (İDT) 1/10 seyreltilerek, yama ve prick testler sulandırılmamış kontrast madde ile yapılır .49,59Deri testleri (prick/İDT/yama testleri) nonirritan konsantrasyonlar kullanılarak yapıldığında genellikle nispeten düşük hassasiyet ve yüksek spesifite ile karakterize edilir. Bu nedenle testin hassasiyetini azaltsa da sulandırılmamış solüsyonla deri testi yapılarak yüksek özgüllük sağlaması tercih edilebilir.59IgE bağımlı reaksiyonlar genellikle çok seyreltik test dozlarında da pozitif olabildiğinden ve nispeten yüksek konsantrasyonlu test solüsyonlarında pozitiflik daha sık elde edildiğinden non-IgE aracılı reaksiyon olabileceği de akla gelmelidir.
Herşeye rağmen yapılan deri testleri maksimum konsantrasyonlarda bile tanı için yetersiz kalabilir. Örneğin, bir çalışmada GBr yaşadığı düşünülen hastalardan prick, geç okumalı İDT ve yama testi negatif saptanan olgulara ilaç provakasyon testi yapıldığında %41.6’sında reaksiyon geliştiği görülmüştür.60,61 Her ne kadar hem ABr hem de GBr yaşayan hastalarada yalancı negatif deri testleri saptanabilse de57,59,61 bu testler, alerjik atak geçirmiş ya da atak için yüksek risk grubunda olan hastalara güvenilir alternatif ajanlar bulmada yararlı bir araçtır .2,30,43
Tanıda bazofil aktivasyon testi yararlı olarak kabul edilen ancak, tanısal değeri tam olarak tespit edilemeyen bir test iken 62,63 bir diğer tanısal araç olan İlaç provokasyon testi hem zaman alıcı hem de hasta için riskli bir alternatiftir ve rutin olarak önerilmez.59,64İlaç provokasyon testi ile korole olarak yapılan deri testlerinin olmayışı, deri testlerinin negatif prediktif değerini azaltmaktadır.58
Ayırıcı Tanı:
RM ile yaşanan reaksiyonun aşırı duyarlılık reaksiyonu mu yoksa başka tür bir reaksiyon mu olduğunu belirlemek için öncelikle dikkatli bir sorgulama yapılmalıdır. Hasta aynı zamanda alerjik reaksiyona neden olabilecek lateks, lokal anestezik, yapışkan bant, lokal antiseptik, antibiyotik gibi ajanlara da maruz kalmış olabilir veya kullanılan ajanın farmakolojik özelliklerinden kaynaklanan yan etkiler (kemotoksisite) doğru hedefi bulmayı zorlaştırabilir.
Kemotoksik yan etkiler ile ani aşırı duyarlılık reaksiyonunda görülen semptomlarda benzerlik olabilir (tablo 1).25 Bu durumda hastalarda sıcaklık basması, kızarma, infüzyon sırasında kolda ağrı, bulantı, kusma şeklinde belirtiler ortaya çıkabilir veya kalp hastalığı olanlarda RM infüzyonu ile intravasküler hacim genişleyerek akut kardiyojenik pulmoner ödem gelişebilir. Bu reaksiyonlar genellikle kendini sınırlayarak geçer ve kontrast maddenin tekrar kullanılmasına engel değildir. Ürtiker veya anjiyoödem görülmemmesi ayırıcı tanıda yardımcı olabilir.13
Vazovagal reaksiyonlarda aşırı duyarlılık reaksiyonlarında olduğu gibi kızarma, baygınlık hissi ve sıcaklık basması hissi ile başlayabilir. Ancak, bradikardi, bulantı, kusma vazovagal reaksiyonlar için tipiktir; aksine aşırı duyarlılık reaksiyonlarında ise taşikardi, kaşıntı, ürtiker, anjiyoödem, laringospazm ve hırıltılı solunum görülür.6Bu durum RM uygulanmasına engel oluşturmaz ve genellikle infüzyon hızı yavaşlatılması ile bulgular geriler, sıvı tedavisi, alt ekstremitelerin yükseltilmesi ve bazen atropin(0,2-0,4 mg İV) verilmesi gerekebilir.1
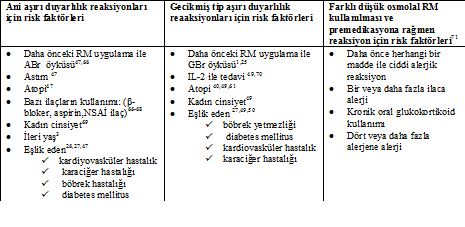
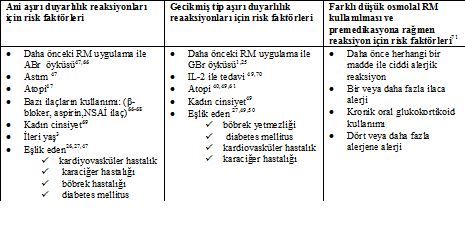
Risk Faktörleri (Tablo 2):
Atopik bireylerde (astım, alerjik rinit, atopik dermatit, besin alerjisi gibi) RM ile ciddi ABr olma ihtimali atopik olmayan bireylere göre üç kat daha fazladır.47 Ancak, bu risk daha çok astım eşlik ediyor olmasından kaynaklanıyor olabilir. Yaygın bir düşünce olmasına rağmen deniz ürünleri alerjisi ABr için bağımsız bir risk faktörü değildir. Deniz ürünleri gıda alerjisinin yaygın bir nedenidir ve gelişen alerji de iyot veya iyodüre karşı değildir.39Herhangi bir atopik birey ya da diğer gıda alerjileri olan hastaların ötesinde riske neden olmaz.47, 65 Ayrıca cilt dezenfektanı olarak kullanılan povidon-iyot ile kontakt dermatit gelişenlerde RM ile daha yüksek ABr riski yoktur.
Bir fikir birliği olmamasına rağmen beta-adrenerjik bloke edici ilaç, aspirin ve diğer nonsteroid antiinflamatuar (NSAİ) ilaçlar gibi bazı ilaçlarla tedavinin ABr riskini veya şiddetini artırdığı ileri sürülmüştür.19,66,67β-blokerler, anafilaksi sırasında epinefrin kullanımını etkisiz hale getirirken eşlik eden bir kalp damar hastalığı var ise daha ciddi bir reaksiyona yol açabilir.68
RM ile ABr yaşayanlarda aynı RM ile GBr gelişme riski daha yüksek oranda değildir.26,49,50 IL-2 T lenfositlerin potent bir uyarıcısı olduğu için IL-2 ile tedavi olanlarda GBr 2-4 kat daha sık oluşur.49 Özellikle ilaç alerjisi ve kontakt alerji olmak üzere atopik hastalarda da GBr olasılığı daha yüksektir.40,49,61
Tablo 2: RM ile gelişen reaksiyonlar için risk faktörleri:
Tedavi:
Hem ABr hem de GBr için tedavide hedef öncelikle risk altındaki hastaları belirleyerek reaksiyon yaşama riskini en aza indirmektir. Ultrasonografi, manyetik rezonans görüntüleme gibi görüntüleme çalışmaları yeterli olabilecekse riskli hastalarada bu yöntemler tercih edilmelidir. Reaksiyon riski taşıyan hastalarada mümkünse alternatif ajan tespit edilerek premedikasyonla birlikte kullanılmalıdır. Fakat premedikasyon yapılması ve alternatif RM kullanılmasına rağmen nadir de olsa reaksiyon gelişebilir, bu durum ‘breakthrough reactions’ olarak adlandırılır.71-7
Koruyucu Önlemler:
Artık birçok merkezde tüm intravasküler prosedürlerde noniyonik düşük/iso-osmolal ajanların ampirik kullanımı daha yaygın bir uygulama haline gelmesi ile reaksiyon görülme olasılığı azalmıştır.74 β- bloker, IL-2, NSAİ ilaç kullanan, astımlı, RM dışında da daha önce ciddi alerjik reaksiyon yaşayan, risk faktörleri iyi bilinmeyen, özellikle kendisi talep eden ve olası bir reaksiyon için çok endişeli hastalarda noniyonik düşük osmolal madde kullanımı ve birlikte premedikasyon önerilmelidir.72Ayrıca astımlı hastalarda uygulama öncesi mümkün olan optimum astım kontrolü sağlanmalıdır. GBr açısından riskli hastalar da bilgilendirilerek bir sorun oluşur ise doktora başvurmaları tavsiye edilmelidir.
1-2 ml gibi düşük miktarlarla bile mortalite olabileceğinden ve test dozunu tolere eden hastalarda tam doz ile ciddi reaksiyon gelişebileceğinden test yapılması önerilmez.75,76
Premedikasyon rejimi:
Deri testlerinin negatif prediktif değeri açısından çok az sayıda bildirim olduğundan daha önce reaksiyon yaşayan hastalara deri testi negatif olsa bile tekrarlayan reaksiyonları önlemek için premedikasyon ve birlikte farklı bir noniyonik düşük/iso-osmolal kontrast ajan kullanılması önerilmelidir.34,37,58 Yüksek osmolal RM ile sistogram gibi ekstravasküler işlem yapılacaksa risk çok düşük olduğu için ve beta-bloker kullanan hastalarda daha önce RM ile ABr yaşanmamışsa premedikasyon gerekmeyebilir.67
ABr yaşamış hastalarda tekrarlayan reaksiyonu önlemede oldukça etkili olduğu görülen çeşitli premedikasyon rejimleri mevcuttur.66,72,73,77,78Yaygın olarak kullanılan yaklaşım noniyonik düşük osmolal kontrast ajan ile birlikte uygulamadan 13 saat önce başlayan glukokortikoid ve H1 antihistaminik kombinasyonu ile yapılan premedikasyon rejimidir (Tablo 3).5,72
Tablo 3: RM ile ABr yaşayan hastalarda premedikasyon:
Glukokortikoidler, bir H1 antihistaminikle kombine edildiği zaman istenmeyen reaksiyonlar %17 -35‘den %5 -10’a düşmektedir.5,66Glukokortikoidlerin farmakolojisine uyumlu olarak işlemden önce iki doz uygulama, işlemden 2 saat önce tek uygulamadan daha etkilidir.73 H1 antihistaminik ve glukokortikoid uygulamasına H2 antihistaminik eklemenin yararı belirlenememiş olsa da bir makalede H1 ve H2-reseptör antagonistlerinin kombinasyonunun tek başına H1 antihistaminik ya da tek başına glukokortikoidden daha etkili olduğunu bildirilmiştir.77Ancak, başka iki makalede ise H1 antihistaminik ve glukokortikoid içeren rejimlere simetidinin eklenmesinin daha sonraki reaksiyonların sayısını azaltmadığı bildirilmiştir.66,78-
GBr riski olan hastalarda ilaç profilaksi değeri belirsiz olmakla birlikte steroid profilaksi önerilir.42,49,79
Premedikasyona rağmen anafilaksi önlenmesi veya GBr’de tekrarlayan reaksiyona karşı koruma sağlanmasının her zaman mümkün olmadığı unutulmamalıdır.49,71
Farklı bir radyokontrast ajan kullanımı:
Tekrarlayan reaksiyonları önlemek için suçlu RM yerine yapısal olarak farklı bir RM tercih edilmelidir:43
– yüksek osmolal RM ile ABr gelişmiş hastalara gelecekteki işlemlerinde noniyonik düşük/iso-osmolal veya gadolinyum bazlı ajan önerilir.
– noniyonik düşük osmolal ajan ile aşırı duyarlılık reaksiyonu yaşamış hastalara premedikasyon ile birlikte ya bir iso-osmolal ajan veya gadolinyum bazlı ajan önerilir. Düşük osmolal ajan ile geçmiş ABr öyküsü olan hastalarda iso-osmolal ajan kullanmanın etkisi özel olarak çalışılmamıştır. Fakat ABr oranı iso-osmolal RM kullanıldığında daha düşüktür.10,11
– GBr yaşamış hastalarda RM kullanımını gerektiren bir durumda noniyonik dimerik RM’den kaçınılmalıdır.79
Gadolinium bazlı ajanlar yaygın olarak manyetik rezonans görüntülemede kullanılmaktadır. Bu ajanların iyotlu RM ile reaksiyon yaşayan hastalarda başarılı kullanımınları bildirimiştir.5,80Ancak, insidansı 400 milyonda 1 olsa da81bu maddelerle özellikle de gadoterate meglumin ile ilk maruziyette gelişen ABr görülebilir.82,83Ayrıca premedikasyona rağmen nadiren ABr de gelişebilir.84Bu ajanlar ile de deri testi yapılarak hastanın tolere edebileceği alternatif gadolinyum bazlı ajan belirlenebilir.82,83
GBr’de tekrarlayan reaksiyonların riskini azaltmak için suçlu RM’den ve deri testlerinde pozitiflik tespit edilen, mümkünse herhangi bir çapraz reaksiyona neden olabilecek ajanlar da dahil kaçınılmalıdır.49
Medikal Tedavi:
RM infüzyonu aşırı duyarlılık reaksiyonu tanınır tanınmaz derhal kesilir ve reaksiyonun şiddetine (Tablo 4) göre tedavi (Şekil 2) verilir.6,25
Tablo 4: Klinik özellikler ve RM’ye bağlı reaksiyonların şiddetinin derecelendirilmesi:
Hafif reaksiyonlarda belirtiler genellikle kendini sınırlar ve 1-2 saat içinde tamamen geçer. Bu nedenle hastanın semptomları geçici ve hafif ise tedavi gerekli olmayabilir. Hemen infüzyon kesilerek hasta gözlem altında tutulur.Fakat infüzyon esnasında ya da hemen sonra başlayan semptomlar şiddeti ne olursa olsun reaksiyon devam etmeye veya kötüye gitmeye eğilim gösterebileceğinden tedavi önerilmektedir. Genellikle sınırlı ürtiker gibi çok hafif belirtiler için difenhidramin verilirek semptomlar ilerler ise hızlıca epinefrin uygulanır. ABr şüphelenilmesi durumunda reaksiyon tekarlayabileceği için semptomlar hızla gerilese bile infüzyon yeniden başlatılmamalıdır .25
Orta ve şiddetli ABr’de tedavi anafilaksi ile aynıdır. Kardiyopulmoner kollaps gelişirse hastalar İleri Kardiyak Yaşam Desteği (İKYD) kılavuzuna göre tedavi edilmelidir. Anafilaksi ve anafilaktik reaksiyon tedavisi için önerilen ilaç epinefrindir.46,85Epinefrin tarafından alfa-adrenerjik reseptör agonizma ile anafilaksi sırasında oluşan vazodilatasyon tersine çevrilir ve hipotansiyon, ürtiker, angioödem geriler. Beta-adrenerjik agonizması bronkodilatasyon oluşturur, kardiyak output artar, mast hücreleri ve bazofiller tarafından enflamatuar aracıların salınması azaltılabilir.85,86 İntravenöz (İV) sıvıların kullanımı ile hücre dışı boşluğa damar içi bölmeden sıvıların hareketiyle ve vazodilatasyona sekonder oluşan göreceli hipovolemi telafisi sağlanmaya çalışılır. Buna ek olarak hasta iyi oksijenlendirilir ve İV glukokortikoid (hidrokortizon 100 mg/eşdeğeri) uygulanarak hemodinamik olarak hasta stabilize edilmeye çalışılır. Acil durum sırasında uygulanan glukokortikoidlerin akut belirtilere etkisi olmadığı düşünülse de gecikmiş belirtilerin şiddetini azaltması veya önlenmesinde faydalı olabileceği düşünülmektedir.13 Entübe edilen ve beta-bloker alan hastalarda daha kapsamlı ve uzun süreli tedavi gerekebilir.9,13
Bazen teşhis ve tedavi için yapılan kardiyak kateterizasyon gibi durumlarda işlem kesilemez ise İKYD kurallarına göre agresif tedavi ile hastayı stabilize etmeye çalışarak prosedür tamamlanabilir.
RM uygulanan tüm yerlerde eğitimli personel ve akut reaksiyonda tedavide kullanılmak üzere ekipman (havayolu cihazları, oksijen, intravenöz sıvılar ve epinefrin) hazır olmalıdır.
GBr gelişenlerde tedavi başka ilaç kaynaklı geçikmiş tip hipersensitive reaksiyonlarında olduğu gibi genellikle antihistaminik, topikal steroid ve nemlendiriciler ile semptomatik olarak yapılır.24,87 Ciddi deri reaksiyonları ya da gerilemeyenler reaksiyonlar için bir dermatolog görüşü alınmasında fayda olacaktır.
Sonuç:
Radyokontrast maddeler ile hem anafilaksi ve anafilaktoid reaksiyonlar hem de geçikmiş tip aşırı duyarlılık reaksiyonları ortaya çıkabilir. Anafilaksi ve anafilaktoid reaksiyonların bulgu ve semptomlarının benzerliğinden dolayı ayırıcı tanı yapılamasa da tedavinin benzer olduğu akıldan çıkarılmamalı ve hiçbir uygulama ile ABr gelişme riskini tamamen ortadan kaldıramadığından klinisyen gerekli durumda acil müdahale için hazırlıklı olmalıdır. Deri testleri ileride gelişebilecek reaksiyonu her zaman doğru tahmin edemese de sadece uygun RM şeçimi ve premedikasyon yapmak yerine birlikte deri testi ile de alternatif ajan belirlemek daha iyi bir yaklaşım olacaktır.
Kaynaklar:
1- Pasternak J.J, Williamson E.E. Clinical Pharmacology, Uses, and Adverse Reactions of Iodinated Contrast Agents: A Primer for the Non-radiologist. Mayo Clin Proc. 2012;87(4):390-402.
2- Kim MH, Lee SY, Lee SE, Yang MS, Jung JW, Park CM et al. Anaphylaxis to Iodinated Contrast Media: Clinical Characteristics Related with Development of Anaphylactic Shock. Plos One. 2014;9(6):e100154.
3- Pradubpongsa P, Dhana N, Jongjarearnprasert K, Janpanich S, Thongngarm T. Adverse reactions to iodinated contrast media:prevalence, risk factors and outcome – the results of a 3-year period. Asian Pac J Allergy Immunol. 2013;31:299-306.
4- Christiansen C. X-ray contrast media:an overview. Toxicology. 2005;209(2):185-187.
5- Newmark JL, Mehra A, Singla AK. Radiocontrast Media Allergic Reactions and Interventional Pain Practice—A Review. Pain Physician. 2012; 15(5):E665-E675.
6- Cochran ST. Anaphylactoid reactions to radiocontrast media. Curr Allergy Asthma Rep 2005; 5:28-31.
7- Grainger R. Intravascular radiological iodinated contrast media. In: Diagnostic radiology: A textbook of medical imaging, 4th ed, Grainger R, Allison DJ, Adam A, Dixon AK (Eds), Churchill Livingston, Oxford 2001. p.27.
8- Ghafoori M. Contrast Agents classification contrast agents in medical imaging. 2012. p. 7-17.
9- Hong SJ, Wong JT, Bloch KJ. Reactions to radiocontrast media. Allergy Asthma Proc 2002; 23:347.
10- Bertrand ME, Esplugas E, Piessens J, Rasch W. Influence of a nonionic, iso-osmolar contrast medium (iodixanol) versus an ionic, low-osmolar contrast medium (ioxaglate) on major adverse cardiac events in patients undergoing percutaneous transluminal coronary angioplasty: A multicenter, randomized, double-blind study. Visipaque in Percutaneous Transluminal Coronary Angioplasty [VIP] Trial Investigators. Circulation 2000; 101(2):131-136.
11- Fransson SG, Stenport G, Andersson M. Immediate and late adverse reactions in coronary angiography. A comparison between iodixanol and ioxaglate. Acta Radiol 1996; 37(2):218-222.
12- Johansson SG, Bieber T, Dahl R, Friedmann PS, Lanier BQ, Lockey RF et al. Revised nomenclature for allergy for global use: Report of the Nomenclature Review Committee of the World Allergy Organization, October 2003. J Allergy Clin Immunol 2004; 113(5):832-836.
13- Lieberman P, Nicklas RA, Oppenheimer J, Kemp SF, Lang DM, Bernstein DI et al. The diagnosis and management of anaphylaxis practice parameter: 2010 update. J Allergy Clin Immunol. 2010; 126(3):477-480.
14- Cashman JD, McCredie J, Henry DA. Intravenous contrast media: use and associated mortality. Med J Aust. 1991; 155(9):618-623.
15- Barrett BJ, Parfrey PS, Vavasour HM, O’Dea F, Kent G, Stone E. A comparison of nonionic, low-osmolality radiocontrast agents with ionic, high-osmolality agents during cardiac catheterization. N Engl J Med. 1992; 326:431-436.
16- Wang H, Wang HS, Liu ZP. Agents that induce pseudo-allergic reaction. Drug Discov Ther. 2011;5(5):211-219.
17- Kim MH, Park CH, Kim DI, Kim KM, Kim HK, Lim KH et al. Surveillance of contrast-media-induced hypersensitivity reactions using signals from an electronic medical recording system. Ann Allergy Asthma Immunol 2012; 108(3): 167–171.
18- Brockow K. Immediate and delayed reactions to radiocontrast media: is there an allergic mechanism? Immunol Allergy Clin North Am 2009; 29:453-468.
19-. Dickinson MC, Kam PCA. Intravascular iodinated contrast media and the anaesthetist. Anaesthesia 2008; 63:626-634.
20- Sutton AG, Finn P, Grech ED, Hall JA, Stewart MJ, Davies A et al. Early and late reactions after the use of iopamidol 340, ioxaglate 320, and iodixanol 320 in cardiac catheterization. Am Heart J. 2001;141(4):677- 683.
21- Böhm I, Schild HH. A practical guide to diagnose lesser-known immediate and delayed contrast media-induced adverse cutaneous reactions. Eur Radiol. 2006; 16: 1570–1579.
22- Christiansen C, Dreborg S, Pichler WJ, Ekeli H. Macular exanthema appearing 5 days after X-ray contrast medium administration. Eur Radiol. 2002; 12:94–97.
23- Christiansen C, Pichler WJ, Skotland T. Delayed allergy-like reactions to X-ray contrast media: mechanistic considerations. Eur Radiol. 2000; 10: 1965–1975.
24- Schild HH, Kuhl CK, Huebner-Steiner U, Böhm I, Speck U. Adverse events after unenhanced and monomeric and dimeric contrastenhanced CT: a prospective randomized controlled trial. Radiology. 2006; 240: 56–64.
25- Böhm I, Heverhagen JT, Klose KJ. Classification of acute and delayed contrast media-induced reactions: proposal of a three-step system. Contrast Media Mol. Imaging. 2012; 7(6): 537–541.
26- Yoshikawa H. Late adverse reactions to nonionic contrast media. Radiology 1992; 183:737–740.
27- Mikkonen R, Kontkanen T, Kivisaari L. Acute and late adverse reactions to low-osmolal contrastmedia. Acta Radiol 1995; 36: 72–76.
28- Federle MP, Willis LL, Swanson DP. Ionic versus nonionic contrast media: a prospective study of the effect of rapid bolus injection on nausea and anaphylactoid reactions. J Comput Assist Tomogr 1998; 22:341-345.
29- Laroche D, Aimone-Gastin I, Dubois F, Huet H, Gerard P, Vergnaud M-C et al. Mechanisms of severe, immediate reactions to iodinated contrast material. Radiology. 1998;209:183–190.
30- Brockow K, Romano A, Aberer W, Bircher AJ, Barbaud A, Bonadonna P et al. Skin testing in patients with hypersensitivity reactions to iodinated contrast media – a European multicenter study. Allergy 2009;64:234–241.
31- Mita H, Tadokoro K, Akiyama K. Detection of IgE antibody to a radiocontrast medium. Allergy 1998;53:1133–1140.
32- Metzger H. The receptor with high affinity for IgE.Immunol Rev. 1992; 1:37-48.
33- Stellato C, de Crescenzo G, Patella V, Mastronardi P, Mazzarella B, Marone G. l. Human basophil/mast cell releasability. XI. Heterogeneity of the effects of contrast media on mediator release. J Allergy Clin Immunol 1996; 97(3):838-850.
34- Szebeni J. Hypersensitivity reactions to radiocontrast media: the role of complement activation. Curr Allergy Asthma Rep 2004; 4:25-30.
35- Szebeni J. Complement activation-related pseudoallergy: a new class of drug-induced acute immune toxicity. Toxicology 2005; 216:106-121.
36- Zir LM, Carvalho AC, Hawthorne JW, Colman RW, Lees RS. Effect of contrast agents on platelet aggregation and 14C-serotonin release. N Engl J Med 1974; 291:134-135.
37- Kanny G, Maria Y, Mentre B, Moneret-Vautrin DA. Case report: recurrent anaphylactic shock to radiographic contrast media. Evidence supporting an exceptional IgE-mediated reaction. Allerg Immunol (Paris) 1993; 25:425-430.
38- Trcka J, Schmidt C, Seitz CS, Bröcker EB, Gross GE, Trautmann A. Anaphylaxis to iodinated contrast material: nonallergic hypersensitivity or IgE-mediated allergy? AJR Am J Roentgenol 2008; 190:666-670.
39- Scherer K, Harr T, Bach S, Bircher AJ. The role of iodine in hypersensitivity reactions to radio contrast media. Clin Exp Allergy. 2010;40(3):468-475.
40- Kanny G, Pichler W, Morisset M, Franck P, Marie B, Kohler C et al. T-cell mediated reactions to iodinated contrast media: evaluation by skin and lymphocyte activations tests. J Allergy Clin Immunol 2005; 115: 179–185.
41- Lerch M, Keller M, Britschgi M, Kanny G, Tache V, Schmid DA et al. Cross-reactivity patterns of T cells specific for iodinated contrast media. J Allergy Clin Immunol 2007;119:1529–1536.
42- Antunez C, Barbaud A, Gomez E, Audonnet S, Lopez S, Gueant-Rodriguez RM et al. Recognition of iodixanol by dendritic cells increases the cellular response in delayed allergic reactions to contrast media. Clin Exp Allergy 2011;41:657–664.
43- Brockow K, Christiansen C, Kanny G, Clément O, Barbaud A, Bircher A et al. Management of hypersensitivity reactions to iodinated contrast media. Allergy 2005; 60(2):150-158.
44- Almen T. The etiology of contrast medium reactions. Invest Radiol. 1994;29(suppl 1):S37-S45.
45- Lieberman P, Nicklas RA, Oppenheimer J, Kemp SF, Lang DM, Bernstein DI et al. The diagnosis and management of anaphylaxis practice parameter: 2010 update. J Allergy Clin Immunol. 2010;126(3):477-480.
46- Simons FE, Ardusso LR, Dimov V, Ebisawa M, El-Gamal YM, Lockey RF et al.; World Allergy Organization. World Allergy Organization Anaphylaxis Guidelines: 2013 update of the evidence base. Int Arch Allergy Immunol. 2013;162(3):193-204.
47- Katayama H, Yamaguchi K, Kozuka T, Takashima T, Seez P, Matsuura K. Adverse reactions to ionic and nonionic contrast media. A report from the Japanese Committee on the Safety of Contrast Media. Radiology 1990; 175:621-628.
48- Wang CC, Chang SH, Chen CC, Huang HL, Hsieh IC. Severe coronary artery spasm with anaphylactoid shock caused by contrast medium-case reports. Angiology 2006; 57:225-229.
49- Bellin MF, Stacul F, Webb JA, Thomsen HS, Morcos SK, Almén T et al.;Contrast Media Safety Committee of European Society of Urogenital Radiology (ESUR). Late adverse reactions to intravascular iodine based contrast media: an update. Eur Radiol. 2011; 21:2305–2310.
50- Hosoya T, Yamaguchi K, Akutzu T, Mitsuhashi Y, Kondo S, Sugai Y et al. Delayed adverse reactions to iodinated contrast media and their risk factors. Radiat Med. 2000; 18:39–45.
51- Loh S, Bagheri S, Katzberg RW, Fung MA, Li CS. Delayed adverse reaction to contrast-enhanced CT: a prospective single- center study comparison to control group without enhancement. Radiology. 2010;255(3):764-771.
52- Rydberg J, Charles J, Aspelin P. Frequency of late allergy-like adverse reactions following injection of intravascular non-ionic contrast media. A retrospective study comparing a nonionicmonomeric contrast medium with a non-ionic dimeric contrast medium. Acta Radiol 1998;39:219–222.
53- Hammerbeck AA, Daniels NH, Callen JP. Ioversol-Induced Acute Generalized Exanthematous Pustulosis A Case Report. Arch Dermatol. 2009;145(6):683-687
54- Vaillant L, Pengloan J, Blanchier D, De Muret A, Lorette G. Iododerma and acute respiratory distress with leucocytoclastic vasculitis following the intravenous injection of contrast medium. Clin Exp Dermatol 1990; 15: 232–233.
55- Laffitte E. Nenadov Beck M, Hofer M, Hohl D, Panizzon RG. Severe Stevens–Johnson syndrome induced by contrast medium iopentol (Imagopaque). Br J Dermatol 2004; 150: 376–378.
56- Brockow K, Vieluf D, Püschel K, Grosch J, Ring J. Increased postmortem serum mast cell tryptase in a fatal anaphylactoid reaction to nonionic radiocontrast medium. J Allergy Clin Immunol 1999; 104:237-238.
57- Dewachter P, Laroche D, Mouton-Faivre C, Bloch-Morot E, Cercueil JP, Metge L et al. Immediate reactions following iodinated contrast media injection: a study of 38 cases. Eur J Radiol 2011; 77:495-501.
58- Caimmi S, Benyahia B, Suau D, Bousquet-Rouanet L, Caimmi D, Bousquet P.J et al. Clinical value of negative skin tests to iodinated contrast media. Clin Exp Allergy 2010;40: 805–810.
59- Brockow K, Garvey LH, Aberer W, Atanaskovic-Markovic M, Barbaud A, Bilo M.B et al. Skin test concentrations for systemically administered drugs – an ENDA/EAACI Drug Allergy Interest Group position paper. Allergy 2013; 68:702-712.
60- Torres M.J, Gomez F, Dona I, Rosado A, Mayorga C, Garcia I et al. Diagnostic evaluation of patients with nonimmediate cutaneous hypersensitivity reactions to iodinated contrast media. Allergy 2012;67: 929–935.
61- Vernassiere C, Trechot P, Commun N, Schmutz J-L, Barbaud A. Low negative predictive value of skin tests in investigating delayed reactions to radio-contrast media. Contact Dermatitis 2004;50:359–366.
62- Salas M, Gomez F, Fernandez TD, Doña I, Aranda A, Ariza A et al. Diagnosis of immediate hypersensitivity reactions to radiocontrast media. Allergy 2013;68: 1203–1206.
63- Pinnobphun P, Buranapraditkun S, Kampitak T, Hirankarn N, Klaewsongkram J. The diagnostic value of basophil activation test in patients with an immediate hypersensitivity reaction to radiocontrast media. Ann Allergy Asthma Immunol 2011;106: 387–393.
64- Aberer W, Bircher A, Romano A, Blanca M, Campi P, Fernandez J et al. Drug provocation testing in the diagnosis of drug hypersensitivity reactions: general considerations. Allergy 2003;58:854–863
65- Schabelman E, Witting M. The relationship of radiocontrast, iodine, and seafood allergies: a medical myth exposed. J Emerg Med. 2010;39:701-707.
66- Greenberger PA, Patterson R, Tapio CM. Prophylaxis against repeated radiocontrast media reactions in 857 cases. Adverse experience with cimetidine and safety of beta-adrenergic antagonists. Arch Intern Med 1985; 145:2197-2200.
67- Greenberger PA, Meyers SN, Kramer BL, Kramer BL. Effects of beta-adrenergic and calcium antagonists on the development of anaphylactoid reactions from radiographic contrast media during cardiac angiography. J Allergy Clin Immunol 1987; 80:698-702.
68- Khan DA, Solensky R. Drug allergy. J Allergy Clin Immunol 2010; 125:126-137.
69- Lee SY, Lim KW, Chang YS.Radiocontrast media hypersensitivity in the Asia Pacific region .Asia Pac Allergy 2014;4:119-125.
70- Shulman KL, Thompson JA, Benyunes MC, Winter TC, Fefer A. Adverse reactions to intravenous contrast media in patients treated with interleukin-2. J Immunother Emphasis Tumor Immunol. 1993;13(3):208-212.
71- Davenport MS, Cohan RH, Caoili EM, Ellis JH. Repeat contrast medium reactions in premedicated patients: frequency and severity. Radiology 2009; 253:372.
72- Greenberger PA, Patterson R. The prevention of immediate generalized reactions to radiocontrast media in high-risk patients. J Allergy Clin Immunol 1991; 87:867-872.
73- Lasser EC, Berry CC, Talner LB, Santini LC, Lang EK, Gerber FH et al. Pretreatment with corticosteroids to alleviate reactions to intravenous contrast material. N Engl J Med. 1987;317(14):845-849.
74- Collins MS, Hunt CH, Hartman RP. Use of IV epinephrine for treatment of patients with contrast reactions: lessons learned from a 5-year experience. AJR Am J Roentgenol 2009; 192:455-461.
75- Fischer HW, Doust VL. An evaluation of pretesting in the problem of serious and fatal reactions to excretory urography. Radiology 1972; 103:497-501.
76- Yamaguchi K, Katayama H, Kozuka T, Takashima T, Matsuura K. Pretesting as a predictor of severe adverse reactions to contrast media. Invest Radiol 1990; 25 :22-23.
77- Ring J, Rothenberger KH, Clauss W. Prevention of anaphylactoid reactions after radiographic contrast media infusion by combined histamine H1- and H2-receptor antagonists: results of a prospective controlled trial. Int Arch Allergy Appl Immunol 1985; 78:9-14.
78- Marshall GD Jr, Lieberman PL. Comparison of three pretreatment protocols to prevent anaphylactoid reactions to radiocontrast media. Ann Allergy 1991; 67:70-74.
79- Watanabe H, Sueki H, Nakada T, Akiyama M, Iijima M. Multiple fixed drug eruption caused by iomeprol (Iomeron), a nonionic contrast medium. Dermatology. 1999;198(3):291- 294.
80- Falco FJ, Moran JG. Lumbar discography using gadolinium in patients with iodine contrast allergy followed by postdiscography computed tomography scan. Spine (Phila Pa 1976) 2003; 28: E1-4.
81- Prince MR, Zhang H, Zou Z, Staron RB, Brill PW. Incidence of immediate gadolinium contrast media reactions. AJR Am J Roentgenol 2011; 196:W138.
82- Chiriac AM, Audurier Y, Bousquet PJ, Demoly P. Clinical value of negative skin tests to gadolinium contrast agents. Allergy 2011; 66:1504.
83- Hasdenteufel F, Luyasu S, Renaudin JM, Paquay JL, Carbutti G, Beaudouin E et al. Anaphylactic shock after first exposure to gadoterate meglumine: two case reports documented by positive allergy assessment. J Allergy Clin Immunol 2008; 121:527.
84- Dillman JR, Ellis JH, Cohan RH, Strouse PJ, Jan SC. Allergic-like breakthrough reactions to gadolinium contrast agents after corticosteroid and antihistamine premedication. AJR Am J Roentgenol 2008; 190:187.
85-Kemp SF, Lockey RF, Simons FE. Epinephrine: the drug of choice for anaphylaxis: a statement of the World Allergy Organization. Allergy. 2008;63(8):1061-1070.
86- Lieberman P. Use of epinephrine in the treatment of anaphylaxis. Curr Opin Allergy Clin Immunol. 2003;3(4):313-318.
87- Sutton AGC, Finn P, Campbell PG, Price DJ, Hall JA, Stewart MJ et al. Early and late reactions following the use of Iopamidol 340, Iomeprol 350 and Iodixanol 320 in cardiac catheterization. J Invasive Cardiol.2003; 5: 133–138.

